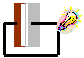Nesta secção vais poder manipular algumas substâncias e construir instrumentos que te ajudam a compreender tudo o que nos rodeia.
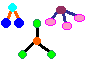
1. Estruturas Moleculares
Objectivo: Visualizar a organização dos átomos ou íons em moléculas ou cristais.
| Material: | Bolas de isopor; |
 | Papel machê; |
| Arame; |
| Borracha de soro; |
| Palitos ou canudos de refrigerante; |
Procedimento: Montar estruturas moleculares com o material sugerido.
Discussão: Assim como as 23 letras do alfabeto latino formam milhares de palavras, algo semelhante ocorre com os átomos, que podem formar milhões de substâncias. Isto nos faz entender porque na tabela periódica temos mais de uma centena de elementos químicos e no quotidiano deparamo-nos com uma diversidade enorme de substâncias. Daí a importância das ligações químicas, um dos conceitos mais importantes desta área.
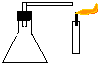
2. Extintor de incêndio
Objectivo: Demonstrar que o gás carbónico extingue a combustão.
| Material/substâncias: | Erlenmeyer; |
 | Rolha com tubo em L; |
| Vela; |
| Ácido acético (5ml); |
| Solução saturada de bicarbonato de sódio (5ml) |
Procedimento: Adicionar a solução de bicarbonato de sódio ao erlenmeyer e em seguida o ácido acético, tampando imediatamente (com a rolha) e mantendo fechado o tubo em L. Após o desprendimento do gás, apontar a saída do tubo em L para a base da chama de uma vela. Observar.
Discussão: O gás carbónico é liberado após a reacção do ácido com o bicarbonato, inibindo a combustão.
| HCO3- (aq) | + | H+(aq) | ® | H2O (l) | + | CO2(g) |
| bicarbonato | ácido | água | gás carbônico |
3. Enchendo um Balão através da Reacção de Vinagre com Bicarbonato de Sódio.
Objectivo: Demonstrar a reacção de bicarbonato de sódio com vinagre produzindo o gás carbónico.
| Material/substâncias: | Erlenmeyer; |
 | Balão de festa; |
| Vinagre (5ml); |
| Bicarbonato de sódio (1colher de sopa); |
Procedimento: Colocar o bicarbonato de sódio ao erlenmeyer e em seguida, adicionar o vinagre. Encaixar a boca do balão na boca do erlenmeyer e esperar a reacção acontecer. Após o desprendimento do gás, pode-se notar que o balão enche rapidamente.
Discussão: O gás carbónico é liberado após a reacção do ácido com o bicarbonato. Assim o balão fica cheio com o gás carbónico.
| HCO3- (aq) | + | H+(aq) | ® | H2O (l) | + | CO2(g) |
| bicarbonato | ácido | água | gás carbônico |
4. Sopro Mágico
Objectivo: Mostrar que o gás carbónico é liberado na respiração e que a reacção entre a água e o gás carbónico produz um ácido.
| Material/substâncias: | Canudos; Tubos de ensaio; Água; |
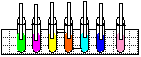 | Estante para tubos de ensaio; |
| Solução bem diluída de hidróxido de sódio; |
| Fenolftaleína; Azul de bromotimol; |
Procedimento: Colocar um pouco de água em um tubo de ensaio, adicionar uma gota de hidróxido de sódio e duas gotas de fenolftaleína (ou azul de bromotimol). Em seguida, soprar com o auxílio de um canudo e observar.
Discussão: Na respiração, expira-se mais gás carbónico do que se aspira. Na experiência, o gás carbónico liberado no sopro reage com a água, produzindo o ácido carbónico que é identificado pelo indicador ácido – base (fenolftaleína, azul de bromotimol).
| CO2(g) | + | H2O(l) | ® | H2CO3(aq) |
| Gás carbônico | água | ácido carbônico |
5. Mágica do vinho
Objectivo: Identificar ácidos e bases.
| Material/substâncias: | Bastão de vidro; | Papel de filtro; | Béquer; |
 | Erlenmeyer; | Funil; | 2 taças; | Água; |
| 1 garrafa de vinho (vazia); | 1 bandeja; | Papel de filtro; |
| Comprimida lacto-purga; | Ácido sulfúrico; |
| Hidróxido de amônio; | Solução de hidróxido de sódio; |
Procedimento:
a) Preparar a fenolftaleína: Com o auxílio do bastão de vidro, triture o comprimido lacto-purga no béquer. Acrescente 20 ml de água e agite. Filtre o sistema, recolhendo a solução resultante em um erlenmeyer.
b) Preparar o vinho mágico (sangue do diabo): Adicione 10 gotas de hidróxido de amónio em 1litro de água. Em seguida, acrescente 10ml da solução do erlenmeyer (fenolftaleína) e observe (a solução se tornará cor de vinho). Depois colocar o vinho mágico em uma garrafa.
c) Preparar a solução de hidróxido de sódio: Colocar 20ml de água em um béquer e adicionar três colheres de sopa de hidróxido de sódio. Mexer com um bastão de vidro e colocar a substância em um vidro conta - gotas.
d) Mágica: Colocar 1gotas de ácido sulfúrico na 1ª taça e 2gotas da solução de hidróxido de sódio na 2ª taça. Em seguida, adicionar um pouco do vinho mágico na 1ª taça e observar. Depois, passar o conteúdo da 1ª taça para a 2ª taça e observar.
Discussão Ácidos e bases podem ser identificados por diferentes procedimentos. A reacção de um ácido com uma base forma água. Os indicadores ácidos - base permitem perceber esta mudança.
| Indicador | Ácido | Base |
| Fenolftaleína | Incolor | Rosa |
| Azul de bromotimol | Amarelo | Azul |
| Hibiscos (papoula) | Vermelho | Verde |
| Repolho Roxo | Vermelho | Azul |
| H+(aq) | + | OH- (aq) | ® | H2O (l) |
| ácido | base | água |
6. Indicadores naturais:
Objectivo: Produzir um indicador ácido - base natural.
Indicador Repolho roxo / Indicador Flores
| Material/substâncias: | Béquer; | Peneira; | Tubos de ensaio; |
 | Estante para tubo de ensaio; | Água; |
|
| Detergente; | Limão; | Vinagre; |
| Leite de magnésia; | Leite; |
| Ájax; | Sabão em barra; |
| Repolho roxo; | Papoula vermelha; |
| Papoula amarela; | Cravo branco; | Cravo amarelo; |
Obs: Pode-se utilizar qualquer produto de limpeza, sucos de frutas ou qualquer substância que se deseje saber se é ácida, básica ou neutra e qualquer tipo de flores para verificar se são indicadores, observando a coloração que apresentam em ácidos ou bases.
Procedimento: Cortar o repolho roxo em tiras bem finas, colocar em um béquer contendo água e levar à fervura. Retirar o béquer do aquecimento, deixar esfriar. Com o auxílio da peneira coar o líquido, passando para outro béquer. Testar a acidez das substâncias, colocando um pouco do líquido em cada tubo de ensaio e 6 gotas das sustâncias citadas acima. Repetir o procedimento para as diversas flores.
Discussão: Os indicadores são substâncias que quando entram em contacto com um ácido apresentam uma determinada coloração e com uma base apresentam outra coloração. Dessa forma, cada indicador apresenta uma mudança de cor característica. Além dos indicadores padrões, existem diversos indicadores naturais. O líquido extraído do repolho roxo é um indicador natural de ácidos e bases e deverá apresentar as seguintes colorações:
| | Meio ácido | Meio neutro | Meio básico |
| Líquido do repolho roxo | Vermelho | Não muda a coloração | Verde |
| Líquido da papoula vermelha | vermelho | Não muda a coloração | Verde |
Obs: O indicador do repolho roxo fica azulado em bases fracas e fica azul escuro com bicarbonato de sódio (NaHCO3).
Sugestão: Fazer uma tabela, seguindo o exemplo da tabela acima para as diversas flores.
7. João Teimoso
Objectivo: Mostrar que o volume ocupado pelo vapor é muito maior do que o ocupado por um líquido.
| Material/substâncias: | Erlenmeyer; |
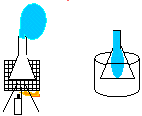 | Balão de festa; |
| Lamparina; |
| Tripé; |
| Béquer; |
| Água; |
| Tela de amianto; |
| Pinça; |
Procedimento: Montar o sistema: lamparina, tripé, tela de amianto. Colocar um pouco de água no erlenmeyer e encaixar o balão de festa na boca do erlenmeyer. Em seguida, colocar em cima da tela de amianto e acender a lamparina. Observar. O balão de festa vai começar a inflar. Retirar o erlenmeyer da tela de amianto com a pinça, esperar esfriar um pouco e colocar em seguida em um béquer com água fria para esfriar completamente.
Discussão: Aquecendo-se a água ela evapora. A pressão interna do recipiente fica maior que a externa. Por isso, ao colocarmos o balão na boca do erlenmeyer ele começa a encher. À medida que o recipiente esfria, ocorre a condensação do vapor, diminuindo-se a pressão interna e fazendo o balão penetrar no recipiente.
8. Existência do Ar
Objectivo: Evidenciar experimentalmente a existência do ar.
| Material/substâncias: | Tubo L com rolha e funil (montados); |
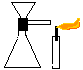 | 1 Erlenmeyer; |
| 1 Vela; |
| Fósforo; |
| Água; |
Procedimento: Você deverá pegar o tubo em L com rolha e funil já montados e encaixar no erlenmeyer. Depois deverá tapar a saída do tubo em L com o dedo e colocar água no funil; em seguida, pegue a vela acesa e aproxime da saída do tubo em L. Solte o dedo e observe o que acontecerá com a chama.
Discussão: a experiência mostra o ar sendo deslocado por outro corpo: a água. Com o dedo obstruindo a saída do ar, a água logo pára de entrar. Isto ocorre por que o ar que está dentro do erlenmeyer não permite que a água ocupe o seu lugar. Quando desobstruímos a passagem, o ar expulso pela entrada da água agita a chama.
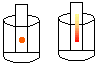
9. Cromatografia em papel
Objectivo: Realizar a separação dos pigmentos que compõem uma determinada cor.
| Material/ substâncias: | Copo; |
 | Papel de filtro; |
| Álcool; |
| Lápis hidrocor de diversas cores; |
Procedimento: Cortar o papel de filtro em tiras. Com o lápis hidrocor, pintar um ponto em uma das extremidades do papel e colocar o mesmo em um copo contendo um pouco de álcool de modo que o ponto pintado com o hidrocor não entre em contacto com o álcool. Observar durante alguns minutos.
Discussão: Na cromatografia, os componentes de uma mistura são identificados pela cor. Colocando uma tira de papel pintada num frasco contendo álcool, é possível identificar os componentes da mistura. O álcool é absorvido gradativamente pela tira e, devido às diferentes solubilidade e tamanhos das moléculas, seus componentes "sobem" com diferentes velocidades, permitindo a identificação das substâncias.
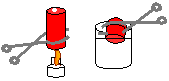
10. Implosão da Lata
Objectivo: Demonstrar o efeito da diferença de pressão.
| Material/substâncias: | Lata de refrigerante; |
 | Béquer; |
| Lamparina pinça p/ a lata; |
| Água; |
| Fósforo; |
| Álcool; |
Procedimento: Coloque um pouco de água (menos de um dedo) na lata de refrigerante vazia. Segure a lata (com a pinça) com seu fundo directamente na chama da lamparina e espere aquecer a água até a sua vaporização. Em seguida verta a lata no béquer com água fria e observe.
Discussão: Antes do aquecimento as pressões interna e externa da lata são iguais. O aquecimento provoca a evaporação da água. O vapor ocupa todo o volume da lata. Quando a lata é resfriada o vapor se condensa.
11. Balança Analítica
Objectivo: Mostrar a precisão nas medidas de massas.
Material: Balança analítica; Fio de cabelo; Papel; Caneta;
Procedimento: Tarar a balança e em seguida colocar um fio de cabelo para verificar o seu peso e anotar, pesar um pedaço de papel e anotar, depois escrever o nome de três pessoas neste mesmo papel e pesar novamente, anotar e comparar com o peso antes das assinaturas.
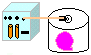
12. Pressão Atmosférica (enchendo um balão com o vácuo)
Objetivo: Formalizar o conceito de pressão experimentalmente.
| Material: | Dissecador; |
 | Bomba de vácuo; |
| Balão de festa; |
| Borracha de soro; |
Procedimento: Montar o sistema: Bomba de vácuo ligada ao dissecador (com um balão de festas previamente fechado e vazio dentro), em seguida ligar o sistema e observar o que ocorre com o balão. Quando o mesmo estiver cheio, desligar e abrir a entrada de ar observando novamente.
Discussão: A pressão atmosférica é devida ao peso de grande massa de ar que atua sobre todos os corpos na superfície terrestre. Como o ar do dissecador é retirado pela bomba de vácuo, sua pressão diminui, tornando a pressão interna do balão maior, inflando-o.
13. Queima do magnésio
Objectivo: Demonstrar uma reacção química de oxidação.
| Material/substâncias: | Pinça de madeira; |
 | Lamparina; |
| Fita de magnésio (pedaço pequeno); |
Procedimento: Pegar um pedaço pequeno de fita de magnésio, encaixar na pinça e aquecer directamente na chama da lamparina a extremidade da fita de magnésio. Observar a reacção:
Discussão: Houve formação do óxido de magnésio (branco) com uma luz intensa (não olhar directamente para a luz para evitar problemas na visão).
| 2Mg | + | O2 | ® | 2MgO (luz intensa) |
| Magnésio | gás oxigénio | Óxido de magnésio |
14. Chuva de ouro
Objectivo: Demonstrar uma reacção química com a formação de um precipitado.
| Material/substâncias: | Tubos de ensaio; |
 | Pinça de madeira; |
| Lamparina; |
| Sol. diluída de nitrato de chumbo (cuidado veneno); |
| Solução diluída de iodeto de potássio; |
Procedimento: Colocar em um tubo de ensaio 2ml da solução de nitrato de chumbo e 2ml da solução de iodeto de potássio, em seguida aquecer o tubo de ensaio em uma lamparina com o auxílio de uma pinça de madeira até que o mesmo se dissolva totalmente. Esperar e observar a lenta cristalização que ficará semelhante a uma chuva de ouro.
Discussão: A reacção obtida é:
| (PbNO3)2 | + | 2KI | ® | 2KNO3 | + | PbI2 |
| nitrato de chumbo | iodeto de potássio | nitrato de potássio | iodeto de chumbo |
Como o iodeto de chumbo é insolúvel em água ocorre a formação de um precipitado amarelo (iodeto de chumbo). Após o aquecimento pode-se observar a lenta cristalização do iodeto de chumbo produzindo um efeito semelhante a uma chuva de ouro.
15. Desidratação do sulfato de cobre (CuSO4. 5H2O).
Objectivo: Demonstrar um fenómeno químico reversível.
| Material/substâncias: | Tubos de ensaio; |
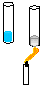 | Pinça de madeira; |
| Lamparina; |
| Água; |
| Sulfato de cobre penta hidratado (CuSO4. 5H2O); |
Procedimento: Colocar um pouco de CuSO4. 5H2O em um tubo de ensaio, aquecer o tubo de ensaio na lamparina com o auxílio de uma pinça de madeira e observar o que ocorre. Em seguida deixe esfriar um poço o tubo de ensaio e depois adicione gotas de água verificando o que ocorre.
Discussão: Com o aquecimento o CuSO4. 5H2O fica desidratada, uma prova é que parte da água que evapora se condensa nas paredes do tubo de ensaio e a substância desidratada (anidra) se torna cinza, após adicionarmos gotas de água a substância volta a ser hidratada e retorna a coloração azul.
16. Algodão doce
Objectivo: Demonstrar a decomposição da água oxigenada.
| Material/substâncias: | Béquer (500ml); |
 | Proveta (50Ml); |
| Espátula; |
| Peróxido de hidrogênio (H2O2); |
| Iodeto de potássio (KI); |
| Detergente; |
| Anilina; |
Procedimento: Adicionar um pouco de cristais de iodeto de potássio na proveta, um pouco de detergente e em seguida acrescentar água oxigenada. Observe.
Discussão: A água oxigenada se decompõe em O2 e água segundo a reacção:
17. Decomposição da água oxigenada (usando batatinha)
| Materiais e reagentes: | Caixa de fósforos; |
 | 1 tubo de ensaio; |
| Água oxigenada; |
| Batatinha; |
Procedimento: Adicionar água oxigenada no tubo de ensaio (aproximadamente um terço) e em seguida jogar uma fatia de batatinha recém-cortada. Observando o aparecimento de uma efervescência acenda um palito de fósforo e em seguida apague a chama, deixando-o em brasa e coloque-o dentro do tubo.
Discussão: Após jogar a batatinha na água oxigenada notamos uma efervescência que é provocada pela liberação do gás oxigénio, proveniente da decomposição da água oxigenada. O gás oxigénio favorece as combustões por esse motivo é que aparece chama na brasa.
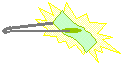
18. Queimando o Real
Objectivo: Ilustrar a combustão do álcool numa solução aquosa.
| Material/substâncias: | Mistura de 60% de água com 40% de álcool; |
 | Fósforo; |
| Pinça; |
| Cédula de um real. |
Procedimento: Mergulhar o real na mistura de água com álcool, em seguida queimar com o fósforo. Observar.
Discussão: O dinheiro é mergulhado numa mistura de água + álcool. O álcool entra em combustão enquanto a água humedece o papel e o protege contra a queima.
19. Fazendo Sabão
Objectivo: Mostrar uma reacção orgânica de saponificação.
| Material/substâncias: | 1 colher de sopa de margarina; Lata; |
 | Lamparina; Bastão de vidro; |
| Hidróxido de sódio a 25% (NaOH); |
Procedimento: Colocar uma colher de sopa de margarina numa lata para aquecer até derreter, adicionar hidróxido se sódio a 25% aos poucos, misturando sempre com um bastão de vidro. Transferir o material para uma forma (molde) e deixar esfriar. Pronto! Fizemos um sabão caseiro.
Discussão: Quimicamente, o que ocorreu foi uma reacção do éster de ácido graxo contido na margarina com o hidróxido de sódio. Esta reacção chama-se saponificação, é um tipo de reacção orgânica (feita em grande escala nos laboratórios produtores de sabões):
| Éster | + | Base | ® | Sal de Ácido Graxo (ou Sabão) | + | Glicerol (ou Glicerina) |
20. Fogo na água
Objectivo: Ilustrar a reactividade dos metais com a água.
| Material/substâncias: | Béquer pinça; |
 | Água; |
| Sódio metálico; |
| Fenolftaleína; |
Procedimento: Colocar um pouco de água no béquer e gotas de fenolftaleína e com o auxílio da pinça, adicionar um pedaço pequeno de sódio. Observar.
Discussão: Os metais são altamente reactivos e reagem com uma grande variedade de substâncias, com não metais e inclusive com a água.
O sódio reage vigorosamente com, a água:
| 2Na (s) | + | 2H2O | ® | H2 | + | 2Na+(aq) 2OH- (aq) |
O gás hidrogénio formado nessa reacção é frequentemente inflamado pelo calor da reacção. (Por esta razão, algumas vezes ocorre uma explosão quando um grande pedaço de sódio é colocado na água). Os íons Na+ e OH- formados nesta reacção permanecem em solução e por esta razão, a solução fica rósea, pois a fenolftaleína (indicador de ácidos e bases) em presença de base adquirem a coloração rósea.
21. Acendendo uma Lâmpada
Objectivo: Mostrar que uma reacção química pode gerar corrente eléctrica.
| Material/substâncias: | Lâmina de cobre, lâmina de zinco, solução de sulfato de cobre, solução de sulfato de zinco, tiras de papel de filtro, |
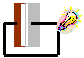 | vidro de relógio, pinça, lâmpada de pequeno potencial e fio de cobre (montado). |
Procedimento: Fazer um sanduíche nesta ordem: Uma lâmina de cobre, papel de filtro humedecido com solução de sulfato de zinco, solução humedecida com solução de sulfato de cobre, placa de zinco. Ligar os terminais da lâmpada nas placas das extremidades. Veja a figura ao lado:
Discussão: A corrente eléctrica resulta do movimento de cargas positivas e negativas dos dois pólos: negativo (alumínio) e positivo (cobre) onde ocorrem as semi-reacções de oxidação e redução respectivamente.
Os sais presentes nos papéis estão dissociados em íons que são responsáveis pelo transporte da corrente eléctrica.
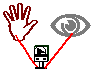
22. Pilha da Mão
Objectivo: Demonstrar uma reacção de oxi-redução através da pilha da mão.
| Material/substâncias: | Placa de cobre (em forma de mão); |
 | Placa de alumínio (em forma de mão); |
| Voltímetro; |
| Fios; |
| Garras para fios; |
Procedimento: uma pessoa coloca as mãos sobre as placa e observa o voltímetro.
Discussão: Esta pilha consiste em duas "mãos" metálicas, uma de cobre e outra de alumínio, (conectadas a um voltímetro).
Nos dois pólos: negativo (alumínio) e positivo (cobre) ocorrem as semi-reações de oxidação e redução respectivamente. Mas a pilha só entra em funcionamento quando o circuito é fechado, e isto ocorre no momento em que sobre as "mãos" metálicas uma pessoa coloca suas duas mãos.
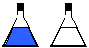
23. Garrafa Azul
Objectivo: Ilustrar a oxidação de um açúcar.
| Material/substâncias: | Erlenmeyers de 250 mL; |
 | Sol. de hidróxido de sódio 5%; |
| Indicadores de pH; |
| 30g de dextrose (glucose); |
| 800mL de solução de hidróxido de potássio 0,7 M; |
Procedimento: a)Adicionar 100mL de solução de KOH no primeiro erlenmeyer, em seguida adicionar 50 ml de KOH nos quatro erlenmeyers restantes e completar 100mL de volume com água. b)Adicionar 3 gotas de solução de NaOH a 5% nos 5 erlenmeyers depois colocar pequena quantidade (cristais) de azul de metileno até a solução adquirir uma coloração azul royal, não coloque muito azul de metileno pois coloração muito escura dificulta a visualização das mudanças de cor. Em seguida adicionar 2g de glicose em todos os recipientes. Observe que a coloração desaparece. Adicione os indicadores apenas em 4 erlenmeyers e está tudo pronto.
Discussão: Quando agitamos o sistema, ocorre a oxidação da dextrose e a substância que era incolor antes da agitação passa a ser azul, pois, entrando em contacto com o ar que está dentro do erlenmeyer ela se oxida, quando volta ao repouso, o ar sobe e, consequentemente, a substância volta a ser a mesma do início e volta também a coloração inicial.
OBS: Esta reacção só poderá ser vista por aproximadamente duas horas, pois a sacarose termina se oxidando totalmente.
24. Misturas Homogéneas e Heterogéneas
Objetivo: Mostrar os tipos de misturas (homogêneas e heterogêneas) com substâncias conhecidas no nosso cotidiano.
| Material/substâncias: | Água; |
 | Sal; |
| Açúcar; |
| Areia; |
| Óleo; |
| Prego; |
Procedimento: Fazer as seguintes misturas anotando o resultado.
Água + Sal = Mistura _________________________________
Quantas Fases? _____________________________________
Água + Óleo = _______________________________________
Água + Areia + Prego= _________________________________
Quantas Fases? ______________________________________
Discussão: Mistura é uma porção de matéria que possui dois ou mais tipos de substâncias.
Misturas homogéneas são aquelas que têm o mesmo aspecto em toda a sua extensão. Só têm uma fase.
Misturas heterogéneas são aquelas que não apresentam o mesmo aspecto em toda a sua extensão. Têm mais de uma fase.
25. Filtração Simples:
Objectivo: Separar a parte sólida da parte líquida de uma mistura heterogénea.
| Material/substâncias: | Funil; |
| Papel de filtro; |
| Béquer; |
| Água + Areia; |
Procedimento: Despeja-se a mistura (Água + Areia) sobre o papel de filtro previamente dobrado e encaixado no funil de vidro e béquer.
Discussão: A filtração consiste em separar a parte sólida da parte líquida de uma mistura. O exemplo mais comum, utilizado no quotidiano é quando está se preparando o tradicional cafezinho do coador de pano ou de filtro de papel.
Em laboratório, a filtração é feita com papel de filtro, funil, bastão de vidro e béquer.
26. Decantação
Objetivo: Separar os componentes de uma mistura heterogênea líquido – sólido usando a decantação por ação da gravidade e por sifonação esperar uma mistura heterogênea líquido - líquido usando o funil de decantação.
Material/substâncias: Mangueira pequena; Suporte com garra; Funil de decantação; Béquer; Água + Areia Água + Óleo;
Discussão: A decantação é o processo de separação que ocorre entre fases de densidades diferentes.
Exemplos:
| a) Em uma mistura de água e areia, por ação da força da gravidade, a areia se deposita no fundo do recipiente, separando-se da água. A água pode ser removida inclinando-se cuidadosamente o recipiente que contém a mistura. | |
| b) Pode-se também retirar a água do recipiente por meio de um sifão. Esta etapa pose ser chamada de sifonação. Adicione a mistura (água + areia) em um béquer, espere que a areia se deposite no fundo do recipiente. Encha uma mangueira pequena de água e segure as duas extremidades com o cuidado para a água não escapar. Segure uma das extremidades dentro do béquer que contem a mistura e a outra dentro de um recipiente vazio, em seguida, solte as duas extremidades da mangueira ao mesmo tempo e espere toda a água ser transferida para o recipiente vazio, com o cuidado de não se misturar com areia. | |
| c) Para separar líquidos imiscíveis, de densidades diferentes, como na mistura de água com óleo, pode-se usar o chamado funil de decantação ou funil de bromo. Adicione a mistura (Água + Óleo), ao funil de decantação. Tampe o funil e agite-o, coloque o funil no suporte e deixe-o em repouso até a separação nítida das duas fases. Abra a torneira e deixe escoar o líquido mais denso em um béquer, feche a torneira e em seguida, passe o líquido menos denso para outro béquer pela boca do funil. | |
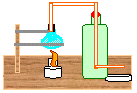
27. Destilação Simples (utilizando material de sucata)
Objetivo: Separar componentes de misturas homogêneas de sólidos dissolvidos em líquidos ou de líquidos em líquidos.
| Material/substâncias: | Base de madeira; Garrafa pet; |
 | Mangueira; Lâmpada; |
| Lamparina; Rolha furada; |
| Cola durepox; Cola de cano; |
| Arame; Caldo de cana; |
Procedimento: Montar o destilador como mostra a figura acima. Adicionar um pouco de caldo de cana no recipiente azul (lâmpada), acender a lamparina e esperar a vaporização. Obs: Quando o vapor começar a ser produzido, irá percorrer pela mangueira que passa por dentro da garrafa (cheia de água fria) e logo, irá se condensar e obteremos a cachaça pingando no recipiente da saída da mangueira.
Discussão: A destilação consiste na separação de uma mistura de sólidos dissolvidos em líquidos ou líquidos em líquidos.
Entre outras aplicações, a destilação é industrialmente usada na separação de diversos subprodutos do petróleo (gasolina, querosene etc.) e na fabricação de bebidas alcoólicas (cachaça, conhaque, uísque etc.).
28. Teste do Combustível
Objetivo: Verificar a qualidade da gasolina.
| Material/substâncias: | Água; |
 | Gasolina; |
| Proveta; |
Procedimento: Encher a proveta até 50 ml (50%) com gasolina. Em seguida completar os 100 ml com água e agitar.
Discussão: A água separa o álcool adicionado à gasolina que, legalmente pode chegar aos 24%. Logo, a gasolina deve ficar em cima do limite de 60 ml ou no mínimo, 40ml.
(SELECIONADO POR RENATYNHO )
ORIGEM:FISICOQUIMICACVG.TRIPOD.COM/EXPERIENCIAS_PARA_FASER_EM_CASA.HTM)